의료기기 국내 인/허가
의료기기·의료용품
의료기기란, 사람이나 동물에게 단독 또는 조합하여 사용되는 기구•기계•장치•재료 또는 이와 유사한 제품으로서 다음 각 호의 어느 하나에 해당하는 제품을 말합니다.
의료기기 갱신제도
의료기기 갱신제도란?
의료기기 품목 갱신제는 의료기기법 제49조(법률 제17248호, 2020.4.7 일부개정)에 따라 2020년 10월 08일부터 의료기기 허가(인증, 신고)의 유효기간을 5년으로 정하고, 만료 전 허가를 갱신 받도록 하는 제도입니다. 허가 후 영구적으로 효력을 유지하던 기존과 달리 5년 동안 제품의 안전성・유효성을 주기적으로 평가하여 허가 유지를 결정합니다.
모든 의료기기는 최초 허가, 인증, 신고일로부터 5년마다 갱신이 필요합니다.
(단, 수출용 의료기기와 조건부의료기기는 유효기간 적용 제외)
기 허가제품의 유효기간에 관한 특례
2020년 10월 8일 이전에 허가, 인증, 신고한 의료기기와 제8조에 따라 재심사를 받은 의료기기에 대한 제조 허가 등의 유효기간은 식품의약품안전처장이 정하여 고시하는 날까지 입니다.
의료기기 표준코드(UDI)
의료기기 표준코드란 의료기기를 식별하고 체계적, 효율적으로 관리하기 위하여 제품의 용기나 외장 등에 표준화된 체계에 따라 표기되는 숫자 또는 문자의 조합을 말합니다.
국내에서 유통 또는 판매되는 의료기기에 대하여 적용하며, 수출용 의료기기는 수출대상국의 요구사항에 따릅니다.
의료기기 표준코드 표시 및 통합정보 등록제도 시행일
UDI 생성 및 통합정보 등록 절차
 의료기기통합정보시스템에 등록하여야 하는 정보
의료기기통합정보시스템에 등록하여야 하는 정보
- - 질병을 진단•치료•경감•처치 또는 예방할 목적으로 사용되는 제품
- - 상해 또는 장애를 진단·치료·경감 또는 보정할 목적으로 사용되는 제품
- - 구조 또는 기능을 검사·대체 또는 변형할 목적으로 사용되는 제품
- - 임신을 조절할 목적으로 사용되는 제품
| 1등급 | 잠재적 위해성이 거의 없는 의료기기 |
|---|---|
| 2등급 | 잠재적 위해성이 낮은 의료기기 |
| 3등급 | 중증도의 잠재적 위해성을 가진 의료기기 |
| 4등급 | 고도의 위해성을 가진 의료기기 |
|
* 의료기기 등급분류의 잠재적 위해성에 대한 판단기준 - 인체와 접촉하고 있는 기간 - 침습의 정도 - 약품이나 에너지를 환자에게 전달하는지 여부 - 환자에게 생물학적 영향을 미치는지 여부 |
|
| 1등급 | 2,3,4등급(임상X) | 2,3,4등급(임상O) | |
|---|---|---|---|
| 제조 | 제조품목신고(1등급) | 제조품목허가(2,3,4등급) | 제조품목허가(임상)(2,3,4 등급) |
| 수입 | 수입품목신고(1등급) | 수입품목허가(2,3,4등급) | 수입품목허가(임상)(2,3,4등급) |
업허가
제조 / 수입 업허가
업변경허가
제조 / 수입
| 허가대상 | 의료기기 제조 / 수입을 업으로 하고자 하는 자 |
|---|---|
| 접수방법 | 식품의약품안전처(MFDS) 종합정보서비스를 통한 인터넷접수 또는 식품의약품안전처 종합민원실에 직접 접수 |
| 처리절차 |
처리기관 : 관할 지방식품의약품안전청 처리기간 : 25일 |
| 구비서류 |
의료기기 제조업허가 신청서 개인 :대표자 건강진단서 및 신청서 내 등록기준지(본적) 기재 ※ 정신질환자, 마약 그밖의 유독물질의 중독자에 해당하지 아니함을 증명 ※ 발행일로부터 6개월 이내 법인 :법인등기부등본(담당 공무원 확인사항) 제조소의 시설내역서(작업소, 시험실, 보관소에 대한 시설도 포함) 위탁계약서 사본(제조공정의 일부나 시험을 위탁하는 경우에 한함) |
| 허가 시 유의사항 | 업허가 신청시 1개 이상의 제조/수입품목허가(신고)를 동시에 접수하여야 함 |
| 허가 처리 절차 |

|
| 허가허가변경 대상 |
법인의 대표자 또는 수입업소의 명칭 및 상호가 변경된 경우 소재지가 변경된 경우 양도양수에 의한 변경 |
|---|---|
| 처리절차 |
접수방법 : 식약처 의료기기 민원사이트 접수 가능 처리기간 : 15일 |
품목신고
제조 / 수입
신고(1등급) 절차도 품목변경신고
제조 / 수입
품목변경신고
제조 / 수입
※ 반드시 30일 이내 보고하여야 하는 변경
| 신고대상 | 제조/수입품목신고를 하고자 하는 자 |
|---|---|
| 처리절차 |
접수기관 : 한국의료기기안전정보원 처리가간 : 식품의약안전처 전자민원시스템상에 등록이 완료된 시점 (3일 소요 ) |
신고(1등급) 절차도
 품목변경신고
제조 / 수입
품목변경신고
제조 / 수입
| 처리절차 | |
|---|---|
|
접수기관 : 한국의료기기안전정보원에 직접 접수 처리기간 : 1~3일 |
|
| 신고변경 대상 | |
|
접수기관 : 한국의료기기안전정보원에 직접 접수 처리기간 : 1~3일 |
|
| 일반적 변경 | 30일 이내 또는 매년 최초 허가 또는 신고일의 전 월 말일부터 역산하여 1년 동안의 변경 내용에 대하여 허가 또는 신고일이 속하는 월의 말일까지 의료기기안전정보원장에게 제출 |
※ 반드시 30일 이내 보고하여야 하는 변경
- 1. 생산 및 수입 중단에 따른 일부 모델명의 삭제
- 2. 경미한 변경에 따른 모델명의 변경 또는 추가
- 3. 상호변경에 따른 제조원 명칭변경 및 제품명 변경
- 4. 수입 의료기기의 수출국 제조자 소재지 변경
- - 허가증 양도양수에 따른 변경
- - 전공정 위탁사항의 변경

품목허가
제조/수입 품목허가
인허가 절차도
2등급제품
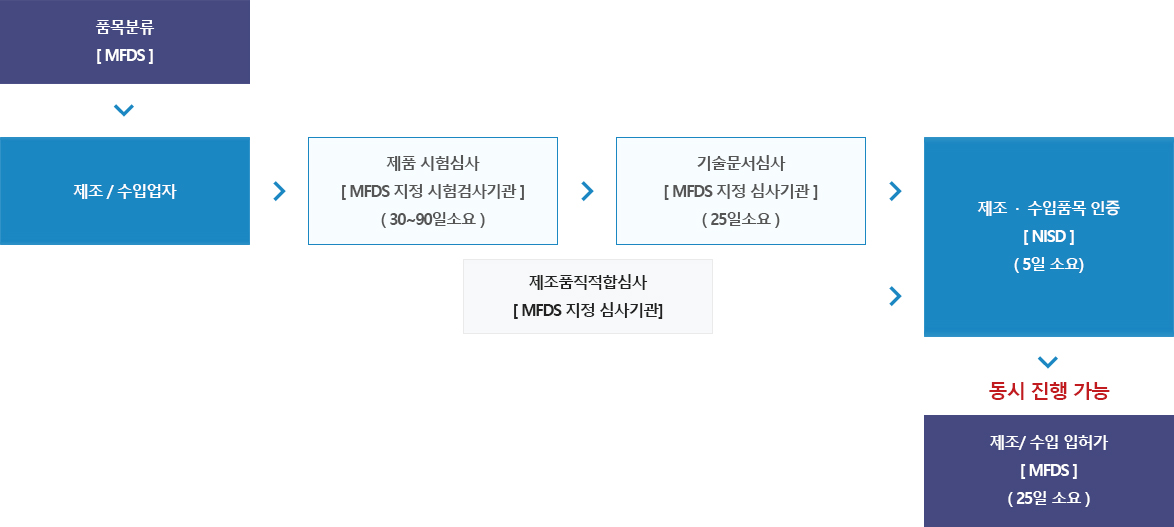 3 / 4등급제품
3 / 4등급제품
 임상시험 자료심사 2 / 3 / 4 등급 제품
임상시험 자료심사 2 / 3 / 4 등급 제품
 품목변경허가
제조 / 수입 품목변경허가
품목변경허가
제조 / 수입 품목변경허가


| 허가대상 | 제조/수입 품목허가를 받고자 하는 자 |
|---|---|
| 처리절차 | 접수방법 : 식약처 의료기기 민원사이트 접수 가능 |
| 처리기간 |
안전성•유효성 심사필요 : 80일 기술문서 심사필요 ㆍ 2등급 : 25일+5일 ㆍ 3 / 4등급 : 65일 기술문서 등 심사불필요 : 10일 |
 3 / 4등급제품
3 / 4등급제품
 임상시험 자료심사 2 / 3 / 4 등급 제품
임상시험 자료심사 2 / 3 / 4 등급 제품
 품목변경허가
제조 / 수입 품목변경허가
품목변경허가
제조 / 수입 품목변경허가
| 처리절차 | 접수방법 : 식약처 의료기기 민원사이트 접수 가능 |
|---|---|
| 처리기간 |
임상시험 자료 심사대상 : 60일 기술문서 심사필요 ㆍ 2등급 : 15일 + 10일 ㆍ3 / 4등급 : 42일 그 밖의 경우: 10일 |
| 허가변경 대상 |
2등급 의료기기 : 안전성 및 성능에 영향을 미치는 변경 동등공고제품 변경 허가대상 2등급, 3등급, 4등급 의료기기 체외진단용 의료기기 경미한 변경 허가증 양도양수에 따른 변경 전공정 위탁사항의 변경 |


| 4등급 | 3등급 | 2등급 | 1등급 |
|---|---|---|---|
| 2019년 7월 1일 | 2020년 7월 1일 | 2021년 7월 1일 | 2022년 7월 1일 |
 의료기기통합정보시스템에 등록하여야 하는 정보
의료기기통합정보시스템에 등록하여야 하는 정보
- - 의료기기 표준코드에 관한 정보
- - 의료기기 제품에 관한 정보
- - 의료기기 제조업자 또는 수입업자에 관한 정보
- - 그 밖에 의료기기에 관한 정보 등
| 위법행위 | 접수방법 : 식약처 의료기기 민원사이트 접수 가능 | |||
|---|---|---|---|---|
| 1차 위반 | 2차 위반 | 3차 위반 | 3차이상 위반 | |
| 가. 의료기기통합정보시스템에 정보를 등록하지 않은 경우 | 해당 품목 판매 업무 정지 1개월 | 해당 품목 판매 업무 정지 3개월 | 해당 품목 판매 업무 정지 6개월 | 해당 품목 제조 및 수입허가/인증 취소 또는 제조/수입 금지 |
| 가. 의료기기통합정보관리기준을 준수하지 않은 경우 | 해당 품목 판매 업무 정지 15일 | 해당 품목 판매 업무 정지 1개월 | 해당 품목 판매 업무 정지 3개월 | 해당 품목 판매 업무 정지 6개월 |



 HOME
HOME